Bei Clinical Trials kann man die Eckdaten zu den Impfstoff-Studien von BioNTech/Pfizer, AstraZeneca, Moderna und Johnson&Johnson einsehen. Nach weiteren Recherchen ist auch klar, die Impfstoffe wurden über die EMA „bedingt“ zugelassen. Das heißt die Impfstoffe dürfen im kompletten EU Wirtschaftsraum verimpft werden, außer ein Land widerspricht diesem explizit. Sie sind damit nicht an das Fortbestehen der epidemischen Lage geknüpft.
Wir haben hier die, derzeit durch eine Notfallgenehmigung/ vorübergehende Zulassung auf den Markt gebrachten, Impfstoffe und das voraussichtliche Ende der Studienzeit aufgelistet:
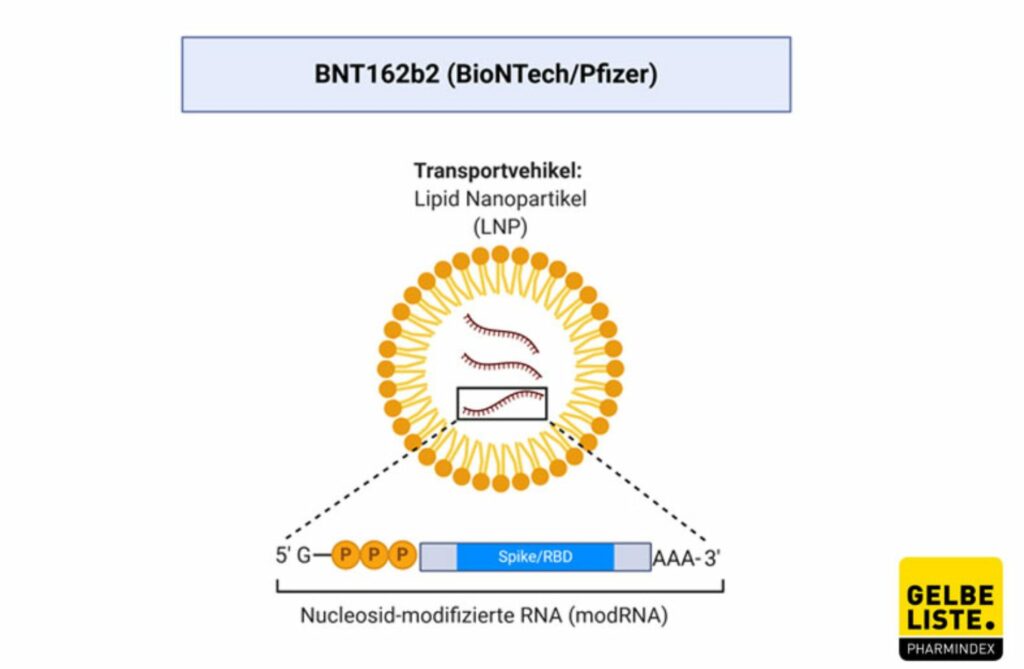
Impfstoff Comirnaty
von BioNTech/Pfizer – mRNA Impfstoff
Notfallgenehmigung/ vorübergehende Zulassung am 21.12.2020 durch die EMA –
Studie endet am 02.05.2023
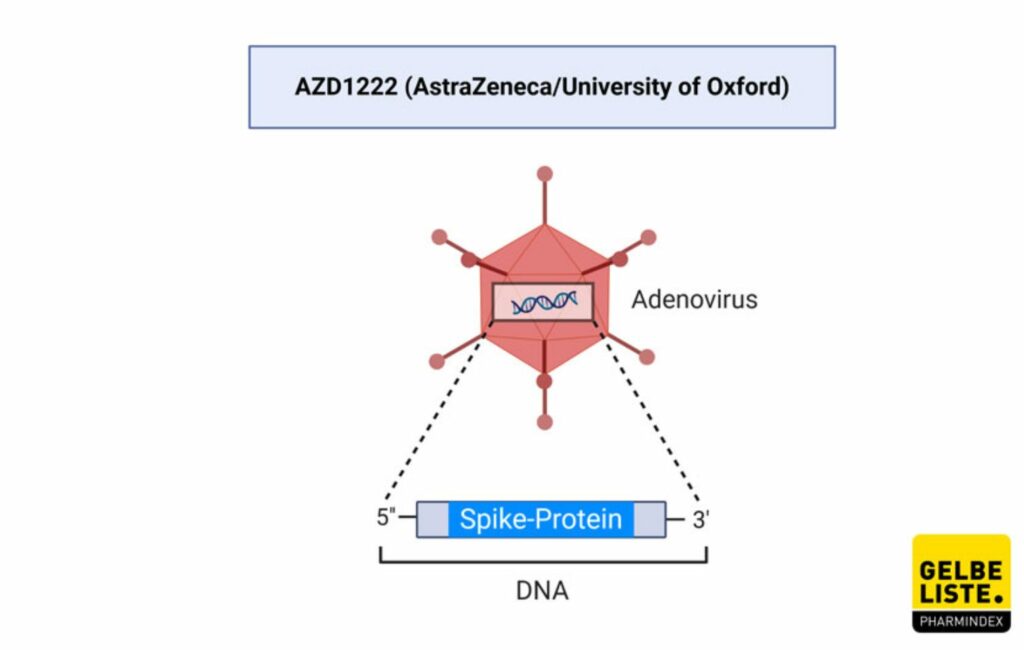
Impfstoff Vaxzevria
von AstraZeneca – Vektorimpfstoff
Notfallgenehmigung/ vorübergehende Zulassung am 29.01.2021 durch die EMA –
Studie endet im Sept. 2021
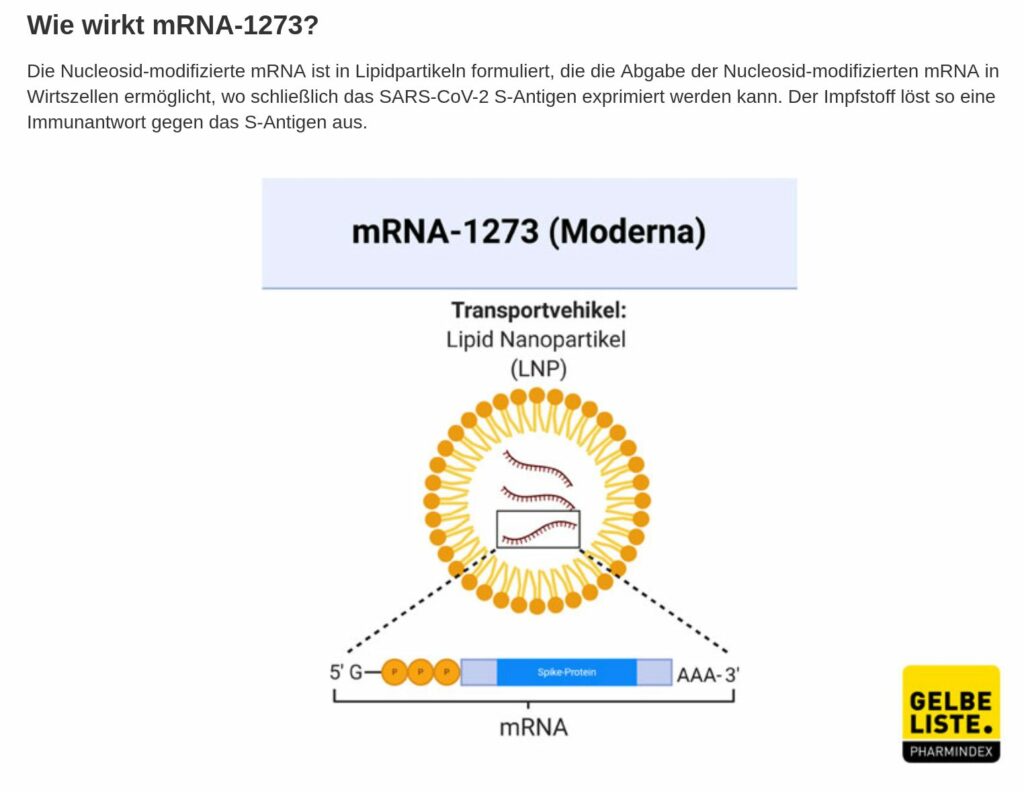
Impfstoff mRNA-1273
von Moderna – mRNA Impfstoff
Notfallgenehmigung/ vorübergehende Zulassung am 06.01.2021 durch die EMA –
Studie endet am 27.10.2022
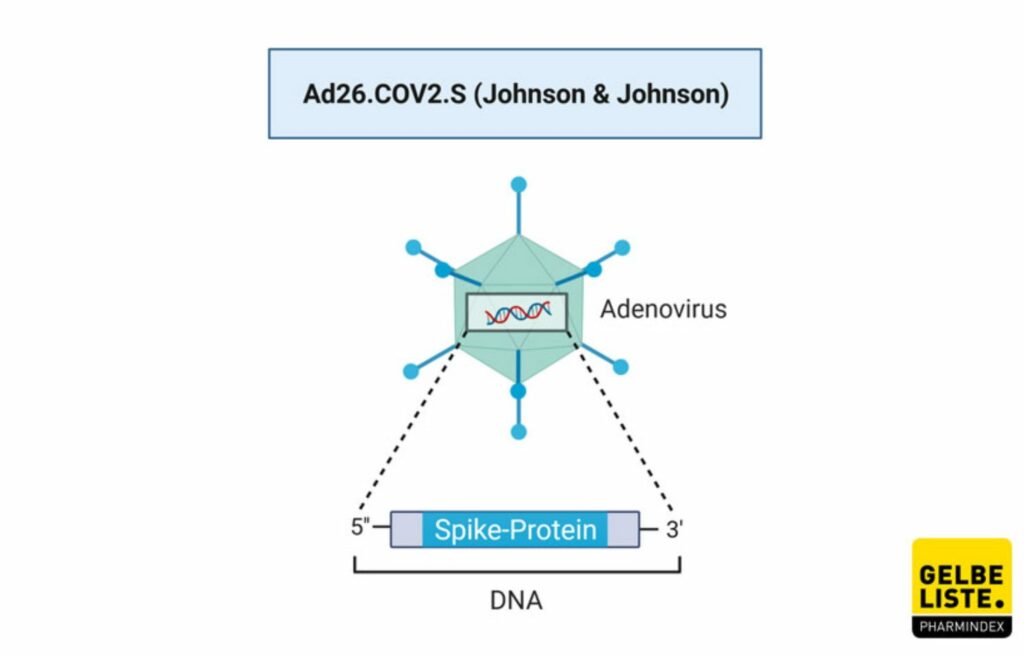
Impfstoff Janssen COVID-19 Vaccine von Johnson&Johnson – Vektorimpfstoff
Notfallgenehmigung/ vorübergehende Zulassung am 11.03.2021 durch die EMA –
Studie I endet am 02.01.2023
Studie II endet am 23.05.2023
Laut PEI sind bedingte Zulassungen ein Jahr lang gültig und können jährlich erneuert werden. Sie können in eine Vollzulassung übergehen.
Alle in der EU und damit in Deutschland zugelassenen COVID-19-Impfstoffe haben eine bedingte Zulassung erhalten (Stand: 23. April 2021).
So schreibt BioNTech-SE in ihrem Konzernabschluss zu 2021 selbst:
Der COVID-19-Impfstoff von BioNTech ist aus dem BNT 162-Programm hervorgegangen und hat aktuell in mehr als 65 Ländern weltweit Notfallgenehmigungen erhalten, vorübergehende Zulassungen erteilt
bekommen oder wurde unter Vorbehalt zugelassen, sodass BioNTech erstmals Erlöse aus dem Verkauf pharmazeutischer Produkte erfassen konnte.
Impfstoff Comirnaty von BioNTech/Pfizer – mRNA Impfstoff Notfallzulassung am 21.12.2020 – Studie endet am 02.05.2023
Der offizielle Titel der Studie lautet:
A Phase 1/2/3, placebo-controlled, randomized, observer-blind, dose-finding study to evaluate the Safety, Tolerability, Immunogencicity, and Efficacy of Sars-Cov-2 RNA vaccine candidates against Covid-19 in healthy individuals
An 162 Studienorten wird hierzu geforscht, außer in Brasilien werden keine Probanden mehr gesucht. Der Status ist active, not recruiting. BNT162b2 ist ein mRNA basierter Corona-Impfstoff, der von BioNTech in Kooperation mit Pfizer entwickelt wurde. Die Studie NCT04368728 ist eine randomisierte, verblindete, Placebo-kontrollierte Phase-II/III-Studie, die die Daten zu Sicherheit, Immunantwort und Wirksamkeit für den Zulassungsantrag evaluiert.
- 43.998 Teilnehmer davon erhielt vermutlich nur die Hälfte den Impfstoff
- Start: 29. April 2020
- Ende: 02. Mai 2023
- Phase II/III
Impfstoff Vaxzevria von AstraZeneca – Vektorimpfstoff Notfallzulassung am 29.01.2021 – Studie endet im September 2021
Der offizielle Titel der Studie lautet:
A Phase 2/3 Study to Determine the Efficacy, Safety and Immunogenicity of the Candidate Coronavirus Disease (COVID-19) Vaccine ChAdOx1 nCoV-19
An 20 Studienorten wird hierzu geforscht, außer am „John Radcliffe Hospital“ werden keine Probanden mehr gesucht. Der Status ist deshalb Recruiting. AZD1222 ist ein Vektor basierter Corona-Impfstoff, der von AstraZeneca entwickelt wurde. Die Studie findet ihr unter folgendem Link NCT04400838 .
- 12.390 Teilnehmer davon erhielt vermutlich nur die Hälfte den Impfstoff
- Start: 28. Mai 2020
- Ende: September 2021
- Phase II/III
- Mehrere Zwischenfälle und zwischenzeitlicher Stopp der Studie
- Falscher Ablauf während Studie – aus Versehen wurde zunächst nur mit halber Dosis geimpft und anstatt die Studie zu stoppen, wurde lediglich das Studienprotokoll geändert.
- Trotz besserer „Wirksamkeit“ bei der Gabe von nur einer Dosis wurde der Impfstoff für die Verwendung der höheren Dosierungen zugelassen (monetäre Anreize?).
- Zunächst hieß es Anwendung nur bei 18- bis 64-Jährige, da es für Ältere keine Studiendaten gab. Dann hieß es
Aufgrund sehr schwerer thromboembolischer Nebenwirkungen darf dieser Impfstoff nur noch an über 60 Jährige verimpft werden. Nun können sich auch Jüngere auf eigene Verantwortung mit dem Corona-Impfstoff impfen lassen.
Impfstoff mRNA-1273 von Moderna – mRNA Impfstoff Notfallzulassung am 06.01.2021 – Studie endet am 27.10.2022
Der offizielle Titel der Studie lautet:
A Phase 3, Randomized, Stratified, Observer-Blind, Placebo-Controlled Study to Evaluate the Efficacy, Safety, and Immunogenicity of mRNA-1273 SARS-CoV-2 Vaccine in Adults Aged 18 Years and Older
An 100 Studienorten wird hierzu geforscht, es werden keine Probanden mehr gesucht. Der Status ist active, not recruiting. mRNA-1273 ist ein mRNA basierter Corona-impfstoff, der von Moderna und dem US-National Institute of Allergy and Infectious Diseases (NIAID) entwickelt wurde. Es handelt sich um einen durch Lipidnanopartikel (diese Hülle ist derzeit unerforscht und niemand weiß, was mit dieser im Körper nach der Injektion passiert, das PEI vermutet, dass diese Hülle für (schwere) allergische Reaktionen verantwortlich ist) verkapselten Impfstoff auf mRNA-Basis, der für ein präfusionsstabilisiertes Spike (S)-Protein von SARS-CoV-2 in voller Länge kodiert.
Grundlage der Notfallzulassung bildet die klinische Phase-III-Studie mRNA-1273-P3018 (Studie NCT04470427) in den USA. Die Studie wurde im Verhältnis 1:1 randomisiert durchgeführt.
- 30.420 Teilnehmer – davon erhielten 15.181 den Impfstoff
- Start: 27. Juli 2020
- Ende: 27. Oktober 2022
- Phase II/III
- Durchschnittsalter 52 Jahre
Impfstoff Janssen COVID-19 Vaccine von Johnson&Johnson – Vektorimpfstoff Notfallzulassung am 11.03.2021 – Studie I endet am 02.01.2023 und Studie II am 23.05.2023
Der offizielle Titel der Studie lautet:
A Randomized, Double-blind, Placebo-controlled Phase 3 Study to Assess the Efficacy and Safety of Ad26.COV2.S for the Prevention of SARS-CoV-2-mediated COVID-19 in Adults Aged 18 Years and Older
An 213 Studienorten wird hierzu geforscht, es werden keine Probanden mehr gesucht. Der Status ist active, not recruiting. Ad26.COV2.S ist ein vektorbasierter SARS-CoV-2-Impfstoffkandidat des US-Pharmakonzerns Johnson & Johnson, der Mutterkonzern des forschenden belgischen Pharmaunternehmens Janssen. Die Vakzine beruht auf einem Adenovirus (Ad26), der die genetische Information für das SARS-CoV-2-Spikeprotein in Form von DNA, enthält. Im Gegensatz zu den bereits zugelassenen Corona-Impfstoffen BNT162b2 (BioNTech/Pfizer), mRNA-1273 (Moderna) und AZD122 (AstraZeneca) wird bei dieser Vakzine nur eine Dosis benötigt.
Aktuell läuft in den USA, Südafrika, Brasilien, Chile, Argentinien, Kolumbien, Peru und Mexiko die multizentrische, randomisierte, doppelblinde, placebokontrollierte Phase-III-Studie namens ENSEMBLE (NCT04505722).
- 44.325 Teilnehmer davon erhielten 21.895 den Impfstoff
- Start: 07. September 2020
- Ende: 02. Januar 2023
- Phase II/III
- 19,5% (n=4.259) waren 65 Jahre und älter und 3,7% (n=809) 75 Jahre und älter.
Weiter läuft eine klinische Phase-III-Studie namens ENSEMBLE 2 (NCT04614948). An 126 Studienorten wird hierzu geforscht, auch in Deutschland am Klinikum rechts der Isar der TU München.
- 30.000 Teilnehmer
- Start: 16. November 2020
- Ende: 23. Mai 2023
- Phase II/III
Seit 26. Februar 2021 läuft eine klinische Phase-II-Studie (NCT04765384) an 400 gesunden Schwangeren. Die Applikation findet während des zweiten und / oder dritten Schwangerschaftstrimesters und (möglicherweise) nach der Geburt statt. Ende wird voraussichtlich der 20. Juni 2023 sein.
Über Ergänzungen und Hinweise freuen wir uns natürlich wie immer, denn ohne Diskurs, keine Weiterentwicklung.
Aktuelle News, zu denen wir keine eigenen Beiträge veröffentlichen, findet ihr auf unserer neu eingerichteten Seite: News: Tagesaktuelle Artikel. Ihr findet diese entweder über den Reiter „Aktuelle Beiträge“ oder oben auf der Startseite als Link.

3 Antworten auf „Alle Covid-Impfstoffe befinden sich in der Phase III Studie – Laufzeit teilweise bis 2023“
Schweinere, geht um Menschen nicht um ein Spiel es sterben täglich Menschen an diesen Impfstoff es wird noch Werbung gemacht BV wie traurig
https://reitschuster.de/post/das-sars-cov-2-spike-protein-ist-zytotoxisch-das-ist-eine-tatsache/
Und dann wird diese Injektion angepriesen wie warme Semmeln, es ist unfassbar
Der Verweis aus die Phase III Studien ist zwar richtig aber vollkommen irrelevant. Denn der ungehinderten Vermarktung steht ja seit der Erstzulassung im Winter 2020/21 praktisch nichts im Wege-also sind die o.g. vier Vakzinkandidaten min. bereits in Phase IV, ohne dass Phase III je abgeschlossen wurde. Die Phase III Studien können ja auch gar nicht mehr regulär abgeschlossen werden, weil viele (nunmehr die meisten) der ursprünglich designierten Placebo-Teilnehmer ja bereits geimpft wurden oder in naher Zukunft noch geimpft werden. Phase III Ergebnisse sind also bereits Makulatur.